Les effets des faibles doses de rayonnements ionisants
Bien qu’à de faibles niveaux de dose d’irradiation, aucun effet sur la santé n’ait été observé au cours de la très grande majorité des études épidémiologiques, l’absence d’effets décelables ne permet pas d’exclure l’existence d’un risque.
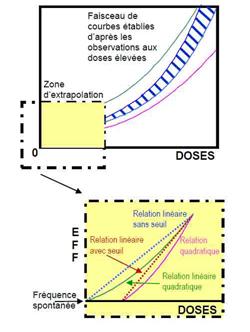
Aussi, pour permettre une gestion simple du risque et dans une logique de prudence, les commissions internationales se sont basées, pour établir les normes, sur une extrapolation des effets observés à fortes doses.
Cette extrapolation, appelée « relation linéaire sans seuil » (ou LNT en anglais pour Linear Non-Treshold Relationship), est fondée sur une relation de proportionnalité entre le risque et les doses reçues.
Variabilité des effets des faibles doses
Cependant, les données scientifiques sur les effets biologiques soulignent l’éventualité de plusieurs formes de relation dose-effets aux faibles doses d’irradiation. Quand une cellule est soumise à de faibles doses d’irradiation, elle ne met pas forcément en oeuvre le même type de réaction que lorsqu’elle est fortement irradiée. Aussi commode soit-elle d’un point de vue réglementaire, l’extrapolation des effets des fortes doses à ceux des faibles doses, ne reflète pas forcément la réalité. Elle rend de ce fait délicate l’identification des risques liés à des expositions aux faibles doses.
Cette tâche est d’autant plus complexe qu’il existe un délai de plusieurs années – voire de dizaines d’années – entre l’irradiation et la déclaration d’une pathologie cancéreuse.
En outre, pendant cette période, de nombreux facteurs environnementaux sont également susceptibles d’introduire des altérations de l’ADN et des perturbations du fonctionnement cellulaire responsables de la cancérogénèse.
L’un des principaux enjeux des recherches est donc d’améliorer les fondements scientifiques de la connaissance des effets des faibles doses dans le but de mieux estimer les risques pour établir des normes de radioprotection de manière plus précise. Il faut ajouter à cela l’absence de spécificité connue des cancers radio-induits et la grande fréquence des cancers survenant spontanément, qui participent, elles-aussi, à la difficulté d’établir l’estimation du risque.
Effets des faibles doses : état des connaissances
Les premiers résultats de recherches menées sur les faibles doses au niveau européen (notamment dans le cadre du projet Risc-Rad) et international ont d’ores et déjà permis d’avancer dans la compréhension des mécanismes de cancérogénèse associés à l’irradiation. Les données obtenues ne remettent pas en question l’utilisation, en radioprotection, de modèles d’estimation du risque basés sur une augmentation linéaire du risque avec la dose de rayonnements. Néanmoins, les études montrent que les faibles doses d’irradiation ont des réponses biologiques spécifiques.
Trois enseignements clés sont ressortis de ces études :
-
il n’y a pas une forme unique de relation dose-effet pour tous les processus biologiques cellulaires
-
les rayonnements peuvent avoir des effets indirects, qui joueraient dans la cancérogénèse un rôle mineur par rapport aux effets directs sur l’ADN
-
les prédispositions génétiques modulent le risque de développer un cancer.
Il n’y a pas une forme unique de relation dose-effet pour tous les processus biologiques cellulaires étudiés.
De nombreux efforts ont porté sur l’exploration des relations entre la dose de rayonnements et les effets sur les processus biologiques impliqués dans la cancérisation. Les différents résultats obtenus mettent en lumière une diversité de réponses à la dose de rayonnements selon le mécanisme biologique étudié :
-
un certain nombre de processus répondent de façon dépendante de la dose. C’est le cas, par exemple, des effets immédiats tels que de l’induction de dommages à l’ADN, d’aberrations chromosomiques et de mutations. D’autres en revanche présentent un seuil de dose en-dessous duquel aucun effet ne peut être observé. C’est le cas notamment du contrôle du cycle cellulaire
-
les effets induits par de faibles doses d’irradiation peuvent être différents de ceux observés lors d’expositions à de fortes doses d’irradiation. La nature de ces différences (qui portent sur le type d’effet, leur cinétique d’apparition…) et leurs implications restent encore à explorer. Mais ces résultats suggèrent qu’il faut prendre en compte cette variabilité
-
enfin, dans certains contextes cellulaires, une faible dose d’irradiation donnée avant une irradiation à forte dose peut conférer une résistance et pourrait donc être bénéfique pour la survie cellulaire.
Si ces résultats n’apportent pas de conclusion définitive quant aux conséquences de la variabilité de réponse en fonction du mécanisme biologique étudié, ils contribueront à mieux définir les facteurs influençant le risque de cancer.
Les rayonnements peuvent avoir des effets indirects
Les rayonnements peuvent avoir des effets indirects, qui joueraient dans la cancérogenèse un rôle mineur par rapport aux effets directs sur l'ADN
Il semblait établi en radiobiologie que les dommages causés à l’ADN dans les cellules irradiées étaient les conséquences directes des effets des irradiations. Cette idée a été remise en question par l’émergence d’un nouveau concept : l’irradiation peut avoir des effets indirects, appelés « effets bystander ». Selon ces derniers, des organes qui n’ont pas été irradiés peuvent subir des dommages liés à l’irradiation d’une autre partie du corps. Ce mécanisme s’explique par l’existence de communications entre les cellules via des molécules produites par les cellules irradiées.
La majorité des études sur ce phénomène avaient jusque là été menées sur des cultures de cellules in vitro et étaient, de ce fait, controversées. Pour la première fois, dans le cadre du programme Risc-Rad, des chercheurs ont obtenu la preuve in vivo de l’existence d’un effet bystander.
L’ensemble de ces résultats suggère que l’apparition d’un cancer radio-induit peut être la conséquence de l’irradiation directe de l’organe mais pourrait être aussi la conséquence d’une irradiation de cellules d’un autre organe par des atteintes indirectes. Des études de modélisation dont l’objectif est de déterminer la contribution relative de ces processus pour les faibles doses de rayonnements sont en cours de développement.
Les prédispositions génétiques
Les prédispositions génétiques modulent le risque de développer un cancer.
À ce jour, on ne connait pas de gènes qui seraient spécifiquement impliqués dans les cancers radio-induits mais les chercheurs disposent d’indications sur l’existence de facteurs de risques génétiques, ceci sur plusieurs types de tumeurs (ostéosarcome, cancer de la peau, lymphome...).
Certains des gènes de prédisposition sont impliqués dans la réponse aux dommages à l’ADN induite par l’irradiation mais aussi dans d’autres voies cellulaires, suggérant ainsi que le nombre de facteurs qui affectent le risque de cancérogénèse radio-induite est beaucoup plus élevé que ce que l’on pensait. Cependant, il semble que dans la majorité des cas, chaque gène ait individuellement peu d’impact en termes de risque, mais y participe dans un réseau complexe d’interactions…).
La nature des mécanismes reliant l’irradiation et ces facteurs de risque génétiques n’est pas encore identifiée, néanmoins la mise en évidence de ces facteurs souligne l’existence d’une susceptibilité individuelle face à une exposition aux rayonnements. Ces résultats confirment la nécessité de mieux connaître les facteurs génétiques de risque pour mieux évaluer la radiosensibilité individuelle. Par ailleurs ces données pourraient avoir des conséquences sur la mise en place des protocoles de radiothérapie.
Conclusion
Les recherches menées dans le cadre du programme européen Risc-Rad, ainsi que celles menées par les acteurs des programmes internationaux sur les faibles doses, montrent que la nature des réponses biologiques induites par de faibles doses d’irradiation présente des différences avec celle des réponses induites par de fortes doses d’irradiation. Elles montrent également la diversité des relations dose-effet selon le mécanisme observé et l’importance des prédispositions génétiques dans la sensibilité individuelle aux faibles doses d’irradiation.
Bien que ces résultats ne remettent pas en cause les normes de radioprotections actuelles, il reste indispensable de continuer à apporter de nouvelles données pour mieux comprendre ces effets biologiques complexes.
De plus, les résultats ont souvent été obtenus au niveau cellulaire. La diversité des réponses induites par les rayonnements est également fonction des types cellulaires observés, du vieillissement des cellules et de l’organisation tissulaire. Il est indispensable de renforcer ces recherches à l’échelle tissulaire et de l’organisme en associant des approches in vitro et in vivo.
